به منظور درك بهتر خواص بخار، مناسب است كه ساختار مولكولی و اتمی بخار و بدنبال آن آب و یخ شناخته شود.
یك مولكول، كوچكترین عضو تشكیل دهنده ماده است كه می تواند با حفظ تمامی خواص شیمیایی آن ماده وجود داشته باشد. مولكول ها خود از عناصر كوچك تری بنام اتم تشكیل شده اند كه مشخص كننده عناصر پایه نظیر اكسیژن یا هیدروژن هستند.
تركیب خاص مولكول ها با یكدیگر منجر به تشكیل ماده مركب می شود. این مواد با فرمول های شیمیایی نظیر H2O كه دارای مولكول هایی مركب از 2 اتم هیدروژن و یك اتم اكسیژن می باشد، نشان داده می شوند.
از آنجائی كه هیدروژن و اكسیژن در بسیاری از تركیبات موجود در كره زمین وجود دارند، آب نیز بسیار در دسترس و ارزان می باشد. كربن نیز المان دیگری از مواد است كه در بسیاری از تركیبات بنیادی به چشم می خورد. بسیاری از مواد می توانند در سه حالت جامد، مایع و گاز وجود داشته باشند كه از آن ها بعنوان فاز نام برده می شود.
در مورد H2 O، فازهای مختلف با عناوین یخ، آب و بخار اسم گذاری شده است.
-نقطه سه گانه بخار
فازهای گاز، مایع و جامد فقط در یك نقطه ثابت دما و فشار می توانند با هم در تعادل باشند كه به نقطه سه گانه معروف است. نقطه سه گانه آب كه تمامی فازها در حال تعادل می باشند، در دمای 273.16K فشار مطلق 0.006112 bar رخ می دهد.
این فشار بسیار نزدیك به خلاء مطلق است و در صورت كاهش بیشتر فشار در این دما، یخ مستقیما به بخار تبدیل می شود.
-یخ
در فاز جامد (یخ)، تمامی مولوكول ها در یك شبكه بهم پیوسته قفل شده و فقط ارتعاش می نمایند. حركت مولكولی در این فاز، بسیار نزدیك به هم بوده و كمتر از اندازه یك مولكول می باشد.
افزایش حرارت باعث افزایش و جدا شدن تعدادی از مولكول ها از مولكول های مجاور گشته و به دنبال آن تغییر حالت جامد به مایع و عمل ذوب شروع می گردد.
(این شرایط در دمای صفر درجه و مستقل از فشار است). مقدار انرژی كه باعث شكسته شدن پیوندهای بین مولكولی و تغییر فاز، بدون افزایش دمای یخ می گردد به آنتالپی ذوب معروف است.
این تغییر فاز برگشت پذیر بوده و در صورت آزاد شدن همان مقدار انرژی به محیط اطراف، قابل انجام است.
چگالی اكثر مواد در هنگام ذوب كاهش می یابد ولی در مورد H2O این امر برعكس بوده، بطوری كه افزایش چگالی آب نسبت به یخ مشاهده می شود. (دلیل شناور ماندن یخ بر روی آب همین مساله می باشد).
-آب
در فاز مایع مولكول ها آزادانه حركت كرده ولی همچنان به علت نیروی جاذبه بین مولكولی در فاصله كمی حركت می نمایند. افزایش حرارت باعث افزایش حركات بین مولكولی و افزایش دما تا دمای جوش می گردد.
-آنتالپی آب، آنتالپی مایع یا گرمای محسوس آب (hr)
این پارامتر میزان انرژی لازم جهت افزایش دمای آب از میزان 00c تا دمای جوش می باشد. در دمای صفر درجه سانتی گراد، آنتالپی آب صفر در نظر گرفته شده و بنابراین تمامی دماهای دیگر با توجه به این مرجع سنجیده می شود.
علت استفاده از واژه گرمای محسوس تغییر دمای محسوس آب با افزایش انرژی می باشد. در فشار اتمسفریك (0 barg)، در دمای 1000c به جوش آمده و به منظور گرمایش یك كیلوگرم آب صفر درجه تا دمای صد درجه، مقدار 419 kj/kg0c انرژی لازم است.
-بخار
با افزایش دمای آب و رسیدن به دمای جوش، برخی از مولكول ها دارای انرژی جنبشی كافی می گردند، به طوری كه می توانند به فضای بالای سطح مایع فرار كرده و جدا شوند. افزایش حرارت باعث افزایش تعداد مولكول های فراری و سپس تشكیل حباب های بخار در داخل مایع می شود كه در سطح آب می تركند.
با در نظر گرفتن ساختار مولكولی، فاز مایع و بخار و فاصله زیاد مولكول ها در فاز بخار، دیده می شود كه چگالی فاز بخار بسیار كمتر از چگالی آب است، بنابراین فضای بالای مایع به سرعت از مولكوله ای با چگالی پایین تر انباشته می شود.
وقتی تعداد مولكول هائی كه آب را ترك می نمایند، از مولكول هائی كه دوباره به آن برمی گردند بیشتر شود، آب بصورت آزاد شروع به تبخیر می نماید. در این نقطه آب به دمای جوش یا دمای اشباع خود می رسد، چرا كه با انرژی حرارتی اشباع شده است.
افزایش بیشتر حرارت با ثابت ماندن فشار، باعث تغییر دمای مضاعف نشده و فقط منجر به تشكیل بخار می گردد. دمای آب جوش و بخار اشباع در فشار ثابت یكسان بوده، ولی میزان انرژی واحد جرم در فاز بخار بسیار بیشتر از فاز مایع است. در فشار اتمسفریك دمای اشباع 1000c است.
با این وجود، در صورت افزایش فشار، امكان انتقال در فشار حرارت بیشتر بدون تغییر مایع وجود دارد. بنابراین افزایش فشار باعث آنتالپی مایع و دمای اشباع می گردد. رابطه بین اشباع و فشار به منحنی اشباع بخار معروف است(شكل1، 2، 2)
آب و بخار در هر فشاری روی منحنی فوق بصورت مشترك و در شرایط دمای اشباع وجود دارند. بخاری كه در شرایط دمائی بالاتر از این منحنی قرار دارد به بخار سوپرهیت معروف است.
-مقدار اختلاف دمای بالاتر از دمای اشباع به درجه سوپرهیت معروف است.
جدول فشار بخار آب در دماهای مختلف
| دما (°C) | فشار بخار (kPa) |
|---|---|
| 0 | 0.611 |
| 10 | 1.228 |
| 20 | 2.337 |
| 30 | 4.243 |
| 40 | 7.382 |
| 50 | 12.344 |
| 60 | 19.925 |
| 70 | 31.168 |
| 80 | 47.371 |
| 90 | 70.115 |
| 100 | 101.325 |
این جدول فقط برای دماهای بین 0 تا 100 درجه سانتیگراد ارائه شده است.
برای دماهای بالاتر از 100 درجه سانتیگراد، میتوانید از نمودارهای فشار بخار آب استفاده کنید.
همچنین میتوانید از نرمافزارهای محاسباتی برای محاسبه فشار بخار آب در دماهای مختلف استفاده کنید.
نکاتی در مورد استفاده از جدول:
- فشار بخار آب با دما افزایش مییابد.
- در دمای ثابت، فشار بخار آب با ارتفاع کاهش مییابد.
- فشار بخار آب اشباع به فشار محیط بستگی ندارد.
اگر بخار خروجی از دیگ به میزان تولیدی باشد و بتواند آزادانه جریان یابد، افزایش حرارت باعث افزایش نرخ تولید بخار می شود، ولی اگر بخار خروجی محدود نگاه داشته شود و همزمان انرژی حرارتی نیز افزوده گردد، انرژی ورودی به دیگ بیشتر از انرژی خروجی شده كه باعث افزایش فشار و بدنبال آن افزایش دمای دیگ می گردد چرا كه دمای اشباع ارتباط مستقیم با فشار دارد.
-به آب در شرایط زیر منحنی، آب زیر اشباع گفته می شود.
-آنتالپی تبخیر یا گرمای نهان ( hrg) آب
این پارامتر مقدار انرژی لازم جهت تغییر فاز آب در حال جوش به بخار می باشد. در این فرآیند هیچ گونه افزایش دمایی رخ نداده و تمام انرژی صرف تغییر فاز می شود. اصطلاح قدیمی گرمای نهان بعلت عدم تغییر دما با وجود افزایش انرژی می باشد، ولی اصطلاح مناسب تر گرمای تبخیر است.
همانند تغییر فاز یخ به آب، فرآیند تبخیر نیز قابل برگشت است. در فرآیند چگالش، میعان یا كندانس، همان مقدار انرژی كه در تولید بخار صرف شده است به محیط اطراف پس داده می گردد. این پدیده در هر زمان كه بخار با سطوح سردتری در تماس قرار گیرد، اتفاق می افتد.
این مقدار انرژی، انرژی موثر و مفید بخار در كاربردهای حرارتی است، زیرا دقیقا میزانی از انرژی است كه هنگام تبدیل بخار به كندانس آزاد می شود.
-آنتالپی بخار اشباع یا انرژی كل بخار اشباع(hg)
این پارامتر انرژی كل بخار اشباع بوده و به راحتی از مجموع آنتالپی آب و آنتالپی تبخیر به دست می آید:
كه در آن: آنتالپی (و دیگر خواص) بخار اشباع به راحتی با استفاده از جداول تجربی موجود كه به جداول بخار اشباع معروف است به دست می آیند.
-جدول بخار اشباع
جدول بخار اشباع، بیان كننده خواص مختلف بخار در فشارهای متفاوت است. این اعداد از آزمایشات واقعی منتج شده اند. جدول 1 ، 2 ، 2 نشان دهنده خواص بخار اشباع در فشار اتمسفریك یا 0 bar g می باشد.

-مثال1 ، 2 ، 2:
در فشار اتمسفریك، آب در دمای 1000c به جوش می آید و انرژی لازم جهت گرمایش یك كیلوگرم آب از دمای 00c تا 1000c برابر 419 kj/kg می باشد. بنابراین آنتالپی ویژه آب در فشار 0 bar g و دمای 1000c برابر 419 kj/kg می باشد.
هم چنین انرژی لازم جهت تبخیر یك كیلوگرم آب صد درجه به یك كیلوگرم بخار صد درجه برابر 2257 Kj می باشد. بنابراین در فشار 0 bar g آنتالپی محسوس تبخیر برابر Kj 2257 می باشد.
آنتالپی كل بخار در فشار 0 bar g برابر است با : 419 + 2257 = 2676KJ/Kg
بخار در شرایط اتمسفریك دارای موارد استفاده محدود می باشد زیرا نمی تواند در طول لوله به سمت نقطه مصرف حركت نماید.
توجه : با دقت در نسبت فشار و حجم بخار اشباع دیده می شود كه با افزایش، حجم مخصوص كاسته می گردد. به همین علت مناسب است كه بخار با فشار حداقل 7bar درون دیگ تولید گردد. تولید بخار در فشار نسبتا بالا موجب حفظ قطر لوله ها و شیرآلات در اندازه های معقول می گردد.
شكل 2 ، 2 ، 2 نشان دهنده رابطه حجم مخصوص و فشار می باشد. دیده می شود كه تغییرات زیاد حجم مخصوص در فشارهای پایین تر اتفاق می افتد و در فشارهای بالاتر (مثلا بالاتر از 7bar) تغییرات حجم مخصوص كمتر می باشد.
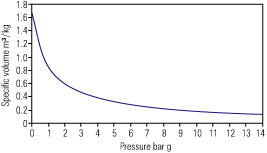
با دقت در جداول بخار 2 ، 2 ، 2 می توان حجم مخصوص و بقیه خواص بخار اشباع را مشاهده نمود.
در فشار bar ، دمای اشباع آب 170 0c می باشد. همانطور كه دیده می شود، آنتالپی آب در این فشار برابر 721 Kj/kg می باشد، كه بیشتر از آنتالپی آب در فشار اتمسفریك (419 Kj/kg ) است.
در مقابل انرژی حرارتی مورد نیاز جهت تبخیر آب در فشار 7bar كمتر از این انرژی در فشار اتمسفریك است و نشان دهنده كاهش آنتالپی مخصوص تبخیر با افزایش فشار می باشد. با این حال، از آنجائیكه حجم مخصوص تبخیر با افزایش فشار می باشد.
با این حال، از آنجائیكه حجم مخصوص نیز با افزایش فشار كاهش می یابد، مقدار انرژی حرارتی قابل حمل توسط حجم ثابتی از بخار با افزایش فشار زیادتر می شود.
-میزان خشكی بخار
در صورت تبخیر كامل آب در فشار ثابت، بخار كاملا خشك اشباع حاصل خواهد شد، در عمل بویلرهای صنعتی امروزی به ندرت قادر به تامین بخار كاملا خشك بوده و بخار حاصل معمولا دارای قطرات آب می باشد.
در حقیقت، به علت تلاطم و آشفتگی داخل دیگ كه خود به علت تركیدن حباب های بخار در سطح آب دیگ است، فضای بالای سطح آب حاوی مخلوطی از بخار و آب است.
در دیگ های Fire-Tube كه در آن ها حرارت آب اعمال شده و بخار در تماس مستقیم با سطح آب است، حدود 5% آب در بخار خروجی وجود خواهد داشت. در این صورت گفته می شود كه بخار تولیدی 95% خشك بوده و یا دارای ضریب خشكی 95% می باشد.
آنتالپی واقعی تبخیر در بخار مرطوب برابر حاصل ضرب ضریب خشكی (x)در آنتالپی تبخیر بخار خشك (hfg) است كه از جدول بخار قابل اكتساب است. بنابراین بخار مرطوب دارای انرژی حرارتی كمتری نسبت به بخار اشباع است.
از آنجائی كه حجم آب بسیار كمتر از حجم بخار است، قطرات آب داخل بخار حجم ناچیزی را اشغال می نمایند و بنابراین حجم مخصوص بخار مرطوب نیز كمتر از بخار اشباع است. معادله زیر نشان دهنده آنتالپی واقعی تبخیر است.
-مثال2 ، 2 ، 2:
بخار در فشار 6barg دارای ضریب خشكی 0.94 بوده و بنابراین دارای 94% آنتالپی بخار اشباع در فشار 6barg است. محاسبات زیرین با توجه به جدول بخار انجام شده است:
-دیاگرام فازی بخار
اطلاعات موجود در جدول بخار می تواند با نمودار گرافیكی بیان گردد. شكل 3، 2، 2 نشان دهنده ارتباط بین آنتالپی و دما در فشارهای مختلف كه به دیاگرام فاز معروف است.
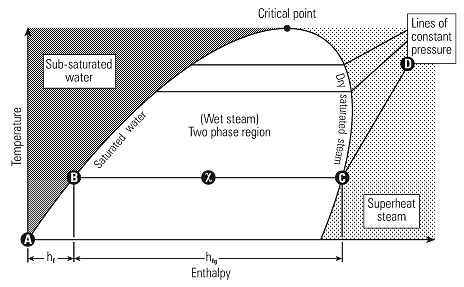
آب با گرم شدن از دمای 0 0c تا دمای اشباع، منحنی مایع اشباع را دنبال نموده تا تمامی آنتالپی مایع یاhr راجذب نماید.(A-B).
با افزایش انتقال حرارت تغییر فاز به بخار اشباع اتفاق افتاده و افزایش آنتالپی در طی فرآیند دما ثابت رخ خواهد داد.(B-C) و hfg.
با افزایش خشكی مخلوط آب و بخار، شرایط مخلوط از خط آب اشباع به سمت بخار اشباع حركت می كند. بنابراین درست در نقطه میانی این دو حالت، ضریب خشكی برابر 0.5 بوده و در خط بخار اشباع، بخار صد در صد خشك خواهد بود.
با ادامه گرمایش بخار از نقطه بخار اشباع، دمای بخار شروع به افزایش در فاز سوپرهیت(C-D) می نماید. منحنی های بخار اشباع بوجود آورنده ناحیه ای هستند كه مخلوط بخار و آب در كنار هم موجود بوده و اصطلاحا بخار مرطوب است.
در ناحیه سمت چپ خط مایع اشباع فقط آب و در ناحیه سمت راست بخار اشباع، بخار سوپر هیت موجود می باشد.
نقطه تلاقی منحنی های مایع اشباع و بخار اشباع به نقطه بحرانی معروف است. با دقت در منحنی دیده می شود كه با افزایش فشار، آنتالپی تبخیر كاهش می یابد تا اینكه در نقطه بحرانی به صفر می رسد و بنابراین در نقطه بحرانی آب مستقیما به بخار تبدیل می شود.
در قسمت بالای منحنی فقط گاز وجود دارد كه در این قسمت مولكول ها بصورت كاملا آزاد در حال حركت می باشند.
دمای نقطه بحرانی بالاترین دمایی است كه آب می تواند داشته باشد و افزایش بیشتر فشار بالای این نقطه منجر به تغییر فاز نخواهد شد.
شرایط نقطه بحرانی در دمای 374.150cو221.2barg می باشد. در فشارهای بالاتر، بخار بعنوان فوق بحرانی شناخته شده و نقطه جوش مشخصی ندارد.
-بخار فلاش
بخار فلاش معمولا در بخار آزاد شده از ونت تانك ها و مخازن كندانس و یا خطوط كندانس خروجی از تله های بخار به چشم می خورد.
این نوع بخار بدون افزایش حرارت به آب و مستقیما در اثر تقلیل فشار آب از فشار بالاتر به پایین تر تشكیل می گردد (در واقع درصدی از آب به بخار تبدیل می شود) (شكل4 ، 2 ، 2)
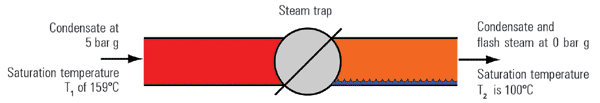
یك كیلوگرم كندانس در فشار 5barg و دمای اشباع 1590c را در نظر بگیرید كه از طریق یك تله بخار به اتمسفر یا فشار 0barg تخلیه می شود. مقدار انرژی موجود در یك كیلوگرم كندانس ورودی برابر 671KJ می باشد(hr).
این مقدار انرژی طبق قانون اول ترمودینامیك، برابر مقدار انرژی در قسمت ورودی و خروجی تله بخار (فشار بالا و پایین) ثابت است. بنابراین مقدار انرژی آب خروجی تله نیز 671KJ خواهد بود.
با نگاه به جدول بخار، مقدار انرژی قابل ذخیره در آب با فشار 0barg برابر 419 Kj است و بنابراین مقدار انرژی 671-419=252 kj در خروجی مازاد خواهد بود كه نمی تواند بصورت آب وجود داشته باشد.
این مقدار انرژی مقداری از كندانس خروجی را تبخیر می نماید كه به بخار فلاش معروف است و از این فرآیند با جوشش آب یا فلاشینگ نام برده می شود.
مقدار بخار فلاش تولیدی در فشار ثانویه (p2) با استفاده از معادله 5 ، 2 ، 2 قابل محاسبه است:
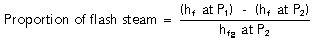
مثال 3 ، 2 ، 2: حالتی كه دمای كندانس فشار بالا بیشتر از دمای كندانس فشار پایین است.
آب با فشار 5barg و دارای 671 kj/kg انرژی حرارتی در دمای اشباع 159 0c می باشد. درصورت كاهش فشار به فشار اتمسفریك (0barg) آب تنها در دمای 100 0c و با انرژی 419 kj/kg وجود خواهد داشت.
تفاوت 252 kj/kg در انرژی حرارتی باعث تولید بخار فلاش در فشار اتمسفر می گردد.
در واقع میزان بخار فلاش تولیدی برابر با نسبت مازاد بر انرژی تبخیر فشار ثانویه می باشد.
مثال4 ، 2 ، 2: حالتی كه دمای كندانس فشار بالا پایین تر از دمای اشباع فشار پایین است.
همان شرایط مثال 3 ، 2 ، 2 را در نظر بگیرید، فقط فرض نمائید كه دمای كندانس فشار بالا برابر 900c می باشد. بنابراین آب ورودی زیر دمای اشباع اتمسفریك (100c) سرد شده است. (توجه : در عمل معمولا این چنین كاهش دمای زیادی از 59 0c1 به 900c در مورد كندانس رخ نداده و فقط بمنظور توضیح عدم تشكیل بخار فلاش در این شرایط ذكر می شود.)
با مراجعه به جدول آب، آنتالپی یك كیلوگرم آب در فشار 5barg و دمای 900c برابر 377 kj است. از آنجائی كه این انرژی كمتر از آنتالپی اشباع یك كیلوگرم آب در فشار اتمسفریك می باشد(419 kj )، بنابراین انرژ ی مازادی وجود نداشته و بخار فلاشی حاصل نخواهد شد.
كندانس به راحتی از تله بخار عبور نموده و ضمن تقلیل فشار در همان دما باقی می ماند.
فشار بخار آب در 900c برابر0.7 barg است.در صورت كاهش بیشتر فشار خروجی كمتر از این مقدار، بخار فلاش مجددا تشكیل می شود.
-اصل تبدیل انرژی و جرم بین دو فرآیند
اصل تبدیل انرژی و جرم اجازه بررسی بخار فلاش را از دیدگاه دیگری بدست می دهد.
شرایط مثال 3 ، 2 ، 2 را در نظر بگیرید كه بصورت شماتیك در شكل 6 ، 2 ، 2 نشان داده شده است و جرم كل آن ثابت است.
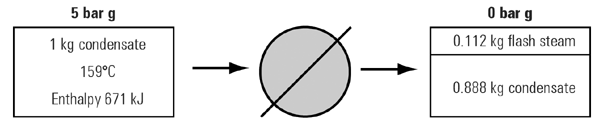
قانون بقای انرژی بیان كننده ثابت ماندن انرژی ورودی و خروجی است و بنابراین مقدار حرارت در بخار فلاش و كندانس در خروجی برابر كندانس ورودی است(671 kj)
از جدول بخار اشباع اطلاعات زیر قابل برداشت است:
بنابراین در فشار اتمسفر خواهیم داشت:
دیده می شود كه قانون بقای انرژی صادق می باشد.
حقایق دیگ بخار
آیا می دانید که یک کیلوگرم آب در 100 درجه سانتیگراد وقتی به فاز گازی یا بخار تبدیل می شود و در فشار اتمسفر چه حجمی بر اساس متر مکعب را اشغال می کند؟
وقتی که یک کیلوگرم (یا یک لیتر آب) ، در دمای 100 درجه و فشار و تحت شرایط یکسان تبدیل به بخار می گردد، حجم ایجاد شده توسط آن 1.66 متر مکعب خواهد بود.
این مقدار که تقریبا 1600 بار افزایش در حجم است سبب ایجاد یک انتشار ناگهانی در فضا است که می تواند سبب تولید یک انرژی بسیار زیاد گردد.
بهتر است ابتدا درك بهتری از بخار پیدا کنیم و ببینیم بخار چیست؟
چگونه می توانیم از بخار استفاده کنیم؟
چه عاملی بخار را بهتر از انواع دیگر مایعات برای حمل و نقل گرما تبدیل نموده است؟
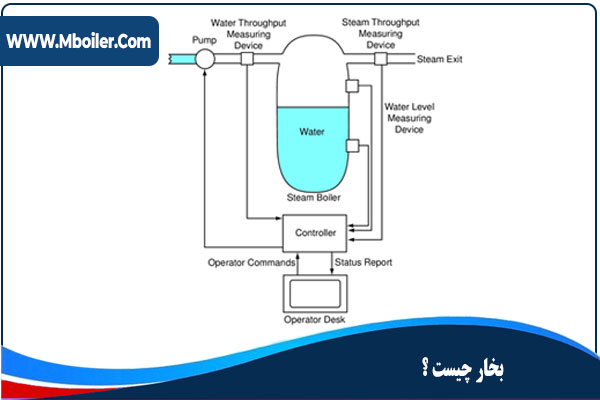
بخارچیست
می دانیم مولکول های آب مانند تمام مواد دیگر در سه حالت وجود دارد، جامد ، مایع و گاز و لذا حالت جامد آب را ما به آن یخ می گوییم و زمانی که به عنوان یک مایع است به آن آب و هرگاه به عنوان یک گاز باشد به آن می گوییم.
بخار یک گاز نامرئی است که با افزودن انرژی گرمایی به آب در دیگ بخار تولید می گردد و این انرژی باید به اندازه ای کافی باشد که سبب اضافه و بالا بردن درجه حرارت آب تا نقطه جوش گردد.
سپس انرژی داده شده به به آب سبب افزایش درجه حرارت آن نمی شود بلکه سبب تغییر فاز و تولید بخار می گردد، این انرژی اضافی است که مورد نیاز برای ایجاد تغییرات آب جوش به بخار است، گرمای تبخیر و یا گرمای نهان نامیده می شود.
برخی از کاربردهای جالب دیگر از بخار
بخار سبب ایجاد نیروی برای حرکت توربین های بخار در نیروگاه برق می باشند که انرژی خود را از سوخت ذغال سنگ دریافت می کند که در نهایت سبب چرخش و تولید برق می شود.
در آتش سوزی ها پاشش آب سبب تولید بخار شده که در اصل با دریافت انرژی توسط آب از آتش سبب کاهش شعله های آن می گردد.
بخار، در حال حاضر در تعدادی زیادی از صنایع استفاده می شود از جمله صنایع : مواد غذایی، کاغذ، نساجی، کارخانه های شیمیایی، برق، حرارت، حمل و نقل ….
*-اتوکلاو بیمارستان برای ضد عفونی تجهیزات و لوازم
*-پخت غذا به روش توسط تزریق مستقیم بخار ، برای مثال پودرها ، مربا ، میوه ، سس ، و غیره
*- ضدعفونی بطری ها
*-تولید شکلات پخت و پز و شکلات نرم با بخار
*-تولید و ساخت پودر شیر، پنیر و لبنیات با بخار
جهت مشاهده متن کامل مقاله فایل زیر را مشاهده نمایید.