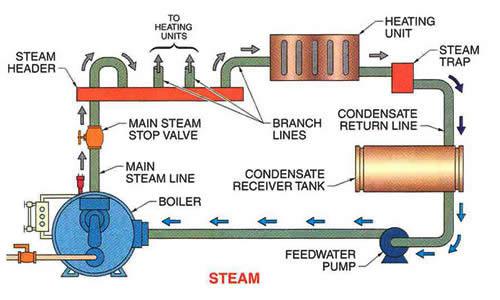
در این مطلب و مطالب بعدی به بررسی زوایای مختلف شیمی احتراق دیگ بخار خواهیم پرداخت. تعریف علمی شیمی احتراق دیگ بخار، ترکیبات شیمایی سوخت، محاسبات احتراق انواع سوخت های جامد و مایع از موارد مورد بررسی هستند.
شیمی احتراق دیگ بخار
طراحی دیگ بخار مستلزم داشتن اطلاعات جامعی از سوخت و مواد حاصل از احتراق آن است. در این فصل محاسبات احتراق که در آن مقادیر هوای لازم، گازهای حاصل و تجزیه و غلظت این گازها بررسی می شود و نیز ارزش گرمایی سوختها مورد بحث قرار می گیرد.
چون در محاسبات احتراق به تعیین غلظت گازها اشاره می شود، ابتدا به تشریح آن می پردازیم:
چگالی گازها
جرم مولی یک جسم عبارت از مجموع حاصلضرب جرم اتمی در تعداد اتمهای هر یک از عناصر شیمیایی فرمول آن جسم است. بنابراین در مونواکسید کربن(co) که یک اتم کربن و یک اتم اکسیژن وجود دارد، با توجه به این که جرم های اتمی آن به ترتیب ۱۲ و ۱۶ است، جرم مولی برابر با ۲۸=۱۶ × ۱ + ۱۲× ۱ می باشد.
در دی اکسید کربن (Co۲) که یک اتم کربن و ۲ اتم اکسیژن دارد، جرم مولی برابر با ۴۴ = ۳۲ +۱۲ = ۱۶×۲+۱۲×۱ می باشد. این محاسبه را می توان برای سایر مواد به کار برد. جرم مولی را می توان در هر یک از واحدهای جرم بیان کرد.
حجم مولی یک گاز حجمی است که توسط جرم مولی آن در شرایط معین دما و فشار اشغال شده است. در واحدهای SI ، جرم مولی تمام گازها حجمی معادل ۲۲.۴m۲۲) ، در (۲۷۳ k) 0ºv و فشار مطلق ۱.۰۱۳bar ، غلظت (co۲) ، یعنی جرم بر حجم برابر است با: در دمای ۰ º c و ۱.۰۱ bar abs است.
برای مثال در مورد (co 44/22.4=1.9643 kg m-۳ دما و فشار ۰ ºc و ۱.۰۱ bar را به نام استانداردهای دما و فشار می نامند.
اصطلاح دیگری نیز به نام دما و فشار نرمال نیز در مباحث شیمی احتراق دیگ بخار به کار می رود که شرایط عادی اتمسفر را نشان می دهد گرچه تعاریف قابل قبول جهانی برای این دو واحد وجود ندارد.
بنابراین در واحد چگالی گازها، برای جلوگیری از ابهام، به شرایط دما و فشار باید اشاره کرد.
در مواردی که فشار و دمای گاز از ۱.۰۱۳ bar و ۰ºc تجاوز می کند، چگالی گاز در شرایط جدید با استفاده از قانون گازها به این صورت محاسبه می شود:
PV=WRT
که در آن :
فشار مطلق P
حجم V
جرم گازی که حجم v را اشغال کرده W
دما بر حسب k T
عدد ثابت جهانی برای گاز R
(همه بر حسب واحد یکسان)
W/V=P/RT = چگالی
P۱/(RT۱) = چگالی
P۲/(RT۲)= ۲ چگالی
بنابراین نتیجه می شود:
(۲چگالی T۲ / P۲ = (۱ چگالی T۱ / R=P۱
که نتیجه می شود
۳-۳ T۱/T۲×(P۲/P۱) × ۱ چگالی = ۲ چگالی
به طور مثال در مورد گاز (co۲)، غلظت در tºc و p بار برابر است با:
×(۲۷۳/(۲۷۳+t×(p/1.013)kg m-۳
۱.۹۶۴۳
چگالی مخلوط گازها
چگالی مخلوط گازها را می توان به سادگی ابتدا با تعیین جرم مولی مخلوط و سپس به کمک اصولی که گفته شد، محاسبه نمود.
به طور مثال چگالی گاز طبیعی طبق آنالیز داده شده در جدول ۳-۱ محاسبه می شود. جرم مولی مخلوط، با ضرب کردن نسبت حجمی هر یک از اجزا در جرم مولی و جمع نتایج به دست می آید.
جدول ۳-۱ تعیین آنالیز جرمی گاز طبیعی به کمک آنالیز حجمی آن
| نسبت جرمی
| درصد جرمی | نسبت جرمی D=B×C | جرم مولکولی C | نسبت حجم | درصد حجم A | فرمول | ترکیب |
| ۰.۸۹۲۲ ۰.۰۵۱۳ ۰.۰۱۰۴ ۰.۰۰۷ ۰.۰۰۴۲ ۰.۰۰۴۰ ۰.۰۰۷۸ ۰.۰۲۳۱ | ۸۹.۲۲۴ ۵.۱۳۴ ۱.۰۳۶ ۰.۶۸۵ ۰.۴۲۵ ۰.۴۰۱ ۰.۷۷۹ ۲.۳۱۳ | ۱۵.۱۲۰ ۰.۸۷۰ ۰.۱۷۶ ۰.۱۱۶ ۰.۰۷۲ ۰.۰۶۸ ۰.۱۳۲ ۰.۳۹۲ | ۱۶ ۳۰ ۴۴ ۵۸ ۷۲ ۳۴ ۴۴ ۲۸ | ۰.۹۴۵ ۰.۰۲۹ ۰.۰۰۴ ۰.۰۰۲ ۰.۰۰۱ ۰.۰۰۲ ۰.۰۰۳ ۰.۰۱۴ | ۹۴.۵ ۲.۹ ۰.۴ ۰.۲ ۰.۱ ۰.۲ ۰.۳ ۱.۴ | CH۴ C۲H۶ C۳H۸ C۴H۱۰ C۵H۱۲ H۲S
CO۲ N۲ | متان اتان پروپان بوتان پنتان سولفور هیدروژن کربن اکسیدازت |
۱.۰۰۰ | ۱۰۰.۰ | ۱۶.۹۴۶ | ۱.۰۰۰ | ۱۰۰.۰ | کل |
جرم مولی مخلوط = ۱۶.۹۴۶
در جدول ۱-۳ خلاصه این محاسبات درج شده است. حاصلضرب ستون b در ستون c مساوی با ستون D است. جمع ارقام ستون D برابر با حجم مولی مخلوط گازها یعنی ۱۶.۹۴۶ می باشد. چگالی مخلوط گاز طبیعی در ۰ºC و فشار ۱.۰۱۳ BAR برابر با ۱۶.۹۴۶/۲۲.۴=۰.۷۵۶۵ kg-۳ می باشد.
راه دیگر محاسبه به این صورت است که چنانچه مقادیر غلظت هر یک از اجزا گاز معلوم باشد، نسبت حجمی (ستون B) هر یک از اجزا را در غلظت آن جزء ضرب کرده و نتایج را جمع می نماییم تا غلظت گاز مخلوط به دست آید. باید دقت کرد که مقادیر چگالی همه در یک شرایط مساوی فشار و دما باشند. تبدیل نتیجه به شرایط مطلوب، طبق معادله ۳-۳ محاسبه می شود.
اجزاء قابل احتراق موجود در کلیه سوخت های فسیلی زغال، نفت و گاز طبیعی عبارت از کربن، هیدروژن و در بعضی موارد گوگرد ترکیب شیمیایی سوخت ها را تشکیل می دهد. این اجزاء به صورت عنصری نیستند بلکه بین خود و گاهی نیز با سایر اجسام ترکیب شده اند . مواد خنثی نظیر سیلیس و اکسیدهای فلزی نیز ممکن است وجود داشته باشند.
ترکیب شیمیایی سوخت ها
آنالیز سوخت های جامد و مایع را بر حسب جرم و آنالیز سوخت های گازی را بر حسب حجم آنها مشخص می سازند.
آنالیز سوخت های جامد به صورت تقریبی، یا نهایی نیز می تواند بیان شود. در آنلیز تقریبی مقدار رطوبت، خاکستر، مواد فرار و کربن ثابت سوخت برحسب درصد وزنی و نیز ارزش گرمایی آن تعیین می گردد.
آنالیز تقریبی اطلاعات محدودی از خصوصیات احتراق ر ا به دست می دهد، ولی آنالیز نهایی سوخت های جامد و مایع عناصر تشکیل دهنده سوخت را که قابل احتراق هستند، همراه با خاکستر و رطوبت آن، مشخص می سازد.
با آنالیز جداگانه ای، اجزا تشکیل دهنده خاکستر هم می تواند مشخص گردد . تجزیه گازها معمولا فقط گازهای تشکیل دهنده آن را به صورت حجمی نشان می دهد.
خشک وبدون خاکستر | خشک | به حالت معمولی | ترکیب |
۶۲.۵ ۳۷.۵ – – | ۵۷.۰۳ ۳۴.۲۲ ۸.۷۵ – | ۵۰.۱۹ ۳۰.۱۱ ۷.۷ ۱۲.۰ | کربن خالص مواد فرار خاکستر رطوبت |
۱۰۰.۰ | ۱۰۰.۰ | ۱۰۰.۰ | کل |
۳۳۶۲۴ | ۳۰۶۸۲ | ۲۷۰۰۰ | انرژی گرمایی kj kg-۱ |
آنالیز نهایی سوخت ها
از آنالیز نهایی برای تعیین هوای لازم احتراق و محصولات حاصل از احتراق استفاده می شود.
آنالیز سوخت های جامد طبق استاندارد BS1016 انجام می شود. آنالیز سوخت های مایع نیز بر حسب استاندارد IP جهت مواد نفتی و فراورده های آن به کار می رود.
آنالیز سوخت های گازی در محل و توسط عرضه کنندگان آن تعیین می گردد.
آنالیز سوخت های جامد، به خصوص زغال، به صورت های مختلف نظیر وضعیت دریافتی، وضعیت احتراق، خنک، خشک و بدون خاکستر یا خشک و بدون مواد معدنی، بیان می شود.
آنالیز های شکل دریافتی و شکل احتراق، به صورت های تقریبی و نهایی فقط در رطوبت موجود آنها تفاوت دارند که با وضعیت ذخیره سازی، آب و هوا، و چگونگی جابجایی سوخت، متغیر است.
جدول ۳-۳
نفت سنگین | زغال | |
۸۵.۴% ۱۱.۴% ۲.۸% ۰.۱% ۰.۱% ۰.۱% ۰.۱% | ۶۶.۰% ۴.۱% ۱.۷% ۷.۲% ۱.۳% ۱۲.۰% ۷.۷% | کربن هیدروژن گوگرد اکسیژن ازت رطوبت خاکستر |
۴۲۹۰۰ | ۲۷۰۰۰ | انرژی گرمایی ناخالص kj kg-۱ |
آنالیز خشک سوخت
آنالیز خشک درصد اجزاء سوخت را بدون رطوبت آن و آنالیز خشک و بدون خاکستر، این آنالیز را بدون رطوبت یا خاکستر نشان می دهد. اجزاء خشک سوخت را می توان با ضرب کردن وضعیت دریافتی یا وضعیت سوخت در حاصل کسر (درصد رطوبت – ۱۰۰) / ۱۰۰ به دست آورد.
اجزاء خشک و بدون خاکستر را می توان با ضرب کردن اجزاء وضعیت دریافتی یا وضعیت احتراق د ر ((رطوبت + درصد خاکستر) – ۱۰۰)/ ۱۰۰ محاسبه کرد.
مقادیر خاکستر و مواد معدنی دقیقا یکسان نیستند زیرا بخشی از مواد معدنی هنگام حرارت دادن جهت تعیین خاکستر، تجزیه شده از بین می روند. بنابراین مقدار خاکستر کمی از مقدار مواد معدنی کمتر است. گاهی اوقات آنالیز خشک و بدون مواد معدنی را “Parr s basis” می نامند.
محاسبات احتراق بر اساس معادله های ساده واکنش شیمیایی اجزاء قابل احتراق سوخت با اکسیژن قرار گرفته است. واکنش های شیمیایی مواد گازی بر اساس حجمی مطابق فرمول های ارایه شده در این مطلب محاسبه می شوند.
محاسبات احتراق
محاسبات احتراق بر اساس معادله های ساده واکنش شیمیایی اجزاء قابل احتراق سوخت با اکسیژن قرار گرفته است.
سوخت های گاز
سوخت های گازی شامل گازهای مایع مواد نفتی سنگین مرکب از مخلوط پروپان و بوتان تا گازهای سبک کوره بلند (ذوب آهن) که محتوی فقط %۲۲ مونواکسید کربن با ۲.۴% هیدروژن رقیق شده با مواد خنثی، دی اکسید کربن و ازت است، می باشد.
از زمان های قدیم گاز طبیعی، معمولی ترین سوخت کوره ها بوده است. این گاز بیشتر شامل متان است که تجزیه آن در جداول مطالب قبلی نشان داده شده است.
گاز دریای شمال بدون گوگرد است، ولی به خاطر تکمیل محاسبات، مقدار ناچیزی هیدروژن سولفره برای آن در نظر گرفته شده است، زیرا به طور کلی گو.گرد از اجزاء تشکیل دهنده سایر سوخت های گازی می باشد.
واکنش های شیمیایی مواد گازی براساس حجمی مطابق فرمول های زیر است:
مقدار حجمی متان ۹۴.۵%
CH۴+ ۲O۲ ® CO۲+۲H۲O
ضرب طرفین واکنش در ۰.۹۴۵ که نسبت حجمی است
۳-۴ (حجم H۲O) 1.89 + (حجم CO۲) ۰.۹۴۵ ® (حجم اکسیژن) ۱.۸۹ + (حجم CH۴ ) ۰.۹۴۵
مقدار حجمی اتان ۲.۹%
C۲H۶+۳.۵O۲®۲CO۲+۳H۲O
ضرب طرفین معادله در ۰.۰۲۹
۳-۵۰.۰۲۹ C۲H۶+۰.۱۰۱۵O۲®۰.۰۵۸CO۲ +۰.۰۸۷ H۲O
مقدار پروپان ۰.۴%
C۳H۸+۵O۲®۳CO۲+۴H۲O
ضرب طرفین معادله د ر۰.۰۰۴
۳-۶۰.۰۰۴ C۳H۸+۰.۰۲O۲®۰.۰۱۲CO۲ +۰.۰۱۶ H۲O
مقدار بوتان ۰۲%
C۴H۱۰+۶.۵O۲®۴CO۲+۵H۲O
ضرب طرفین معادله د ر۰.۰۰۲
۳-۷۰.۰۰۲ C۴H۱۰+۰.۰۱۳O۲®۰.۰۰۸CO۲ +۰.۰۱ H۲O
پنتان ۰.۱%
C۵H۱۲+۸O۲®۵CO۲+۶H۲O
ضرب طرفین معادله د ر۰.۰۰۱
۳-۸۰.۰۰۱ C۵H۱۲+۰.۰۰۸O۲ ® ۰.۰۰۵CO۲ + ۰.۰۰۶ H۲O
هیدروژن سولفره ۰.۰۲%
H۲S + 1.5O۲ ® SO۲+H۲O
ضرب طرفین معادله د ر۰.۰۰۲
۳-۹۰.۰۰۲ H۲S+0.003O۲®۰.۰۰۲SO۲ +۰.۰۰۲ H۲O
باید توجه داشت که حجم های دو طرف معادله از نظر مجموع، یکسان نیستند، این موضوع در معادله های بالا مشهود است.
مرحله بعدی خلاصه کردن معادله های فوق برای به دست آوردن مقدار اکسیژن لازم (به مقدار تئوری) Stoichhiometric است. جهت نیتروژن موجود در هوای سوخت و هوای اضافی لازم جهت تکمیل احتراق (۱۰% در این مورد)، مقادیری منظور شده و سپس محصولات احتراق بر اساس مرطوب و خشک محاسبه شده است.
در عمل هوای احتراق شامل مقدار کمی رطوبت است، که در صورت معلوم بودن مقدار آن (Humidity)، می توان آن را محاسبه و همراه با هوای اضافی به محصولات احتراق اضافه نمود.
این مطالب را هم ببینید:
 |  |  |  |  |  |